▲南韓進行AZ、輝瑞疫苗混打臨床實驗。(圖/路透社)
● 陳秀熙/台灣大學公共衛生學院預防醫學與流行病學研究所教授
● 廖思涵/台灣大學醫學院附設醫院癌醫中心分院主治醫師
● 賴昭智/台北市立聯合醫院仁愛院區主治醫師
● 張維容/台灣大學公共衛生學院預防醫學與流行病學研究所博士後研究員
● 許辰陽/台灣大學公共衛生學院公共衛生碩士學位學程兼任助理教授
● 嚴明芳/台北醫學大學口腔醫學院口腔衛生學系教授
簡介
在全世界使用的新冠肺炎疫苗其研發的技術各不相同,例如輝瑞BNT和莫德納Moderna為mRNA疫苗,目前國內普及率最高的牛津AZ疫苗,和嬌生疫苗一樣,都是腺病毒載體疫苗,而Novavax疫苗和國內自行研發的高端及聯亞疫苗一樣,則是重組蛋白疫苗,這些不同類型的疫苗是否可以混打引發全世界科學關注而世界衛生組織的首席科學家Soumya Swaminathan在7月12日的簡報會議中更提到說:「就混打疫苗而言,我們處於一個缺乏資料和證據的領域,關於混打的數據有限,正在進行研究,我們需要等待。」
近期陸續發表的疫苗混合施打科學實證結果顯示,相較於施打同樣的疫苗,混合不同的疫苗施打可達到提升施打後中和抗體濃度的效益。因此對於疫苗混合施打的科學原理及實證評估對於回答「疫苗可以混打嗎?」應有相當助益。
疫苗混打的實證科學證據
首先會針對「AZ-BNT」和「AZ-Moderna」,即一劑施打AZ這類腺病毒載體疫苗,另一劑混打BNT或Moderna這類mRNA疫苗現有的臨床試驗和結果一一介紹。
首先,介紹三個「AZ-BNT」疫苗混打相關的臨床試驗,分別在西班牙、英國和德國進行。
1. 西班牙的「AZ-BNT」疫苗混打的臨床試驗(CombiVacS trial)
西班牙在今年四月開始進行疫苗混打的臨床試驗,共納入663位曾施打過一劑AZ疫苗的受試者,用1比2的比例進行隨機分派,其中一組未施打第二劑疫苗,共222位受試者,另一組第二劑施打BNT疫苗,共441位受試者。
圖一為西班牙AZ-BNT疫苗混打研究設計。試驗結果發現「AZ-BNT」疫苗混打組,相較於只打一劑AZ疫苗者,受試者的血清中有較高的中和抗體保護效力,在安全性方面,「AZ-BNT」疫苗混打組最常見的不良反應包括注射部位疼痛(88.2%)、頭痛(44.4%)、肌肉痠痛 (43.3%)和疲倦(43.3%),經專家評估,這些不良反應大多是輕中度且可自行緩解,不過要注意的是此研究並未提供只施打一劑AZ疫苗的對照組的不良反應發生比例(Borobia et al., 2021)。
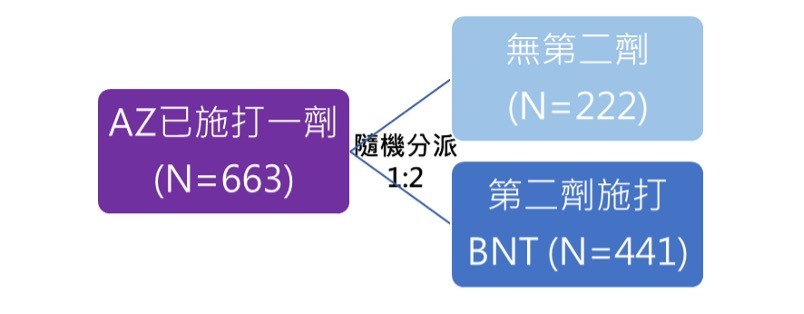
▲圖一:西班牙AZ-BNT混打研究設計。(圖/作者團隊提供)
2. 英國的「AZ-BNT」疫苗混打的臨床試驗(Mixed and match trial)
該研究於今年二月在英國開始進行,評估AZ-BNT的混打效益與副作用,其研究設計如圖二。
此研究共納入830位50歲以上的受試者進行隨機分派分成8組,其中463位受試者的兩劑疫苗施打間隔為4週,367位受試者的施打間隔則為12週,而疫苗混打的組合包括「先AZ後AZ」、「先AZ後BNT」、「先BNT後BNT」和「先BNT後AZ」共4種,加上施打間隔的不同,所以共有8組,每組的受試者約100人,實驗架構如圖二。
而目前施打間隔為4週的受試顯示如果兩劑疫苗的施打間隔為4週時,不論是「先AZ後BNT」或「先BNT後AZ」這樣的疫苗混打者都比兩劑皆打AZ疫苗者,血清的中和抗體反應都較高;在安全性方面,不論是「先AZ後BNT」或「先BNT後AZ」這樣的疫苗混打組發生全身性不良反應的比例皆較兩劑都打AZ或BNT疫苗組來得高,以常見的發燒發熱為例,「先AZ後BNT」組的發生比例為34%(110位受試者中有37位發生),對照「先AZ後AZ」組則為10%(112位受試者中有11位發生);而「先BNT後AZ」組的發生比例為41%(114位受試者中有47位發生),對照「先BNT後BNT」組則為21%(112位受試者中有24位發生),其他常見的全身性不良反應如發冷、疲倦、頭痛、關節痛和肌肉痠痛也都有類似的情形(Liu et al., 2021)。
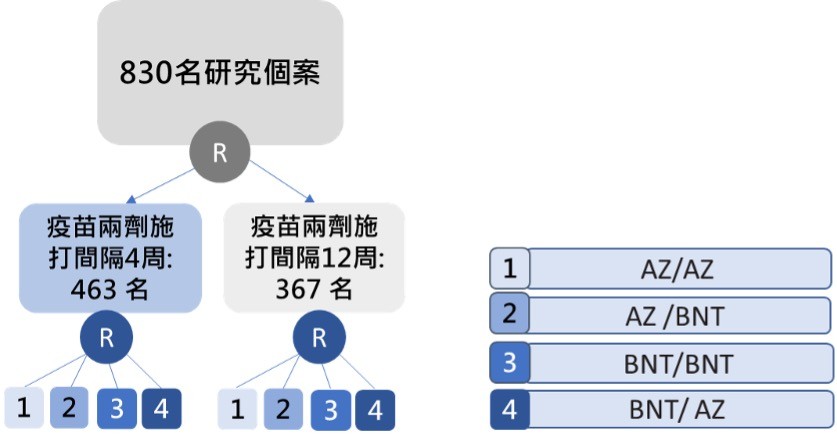
▲圖二:英國雙拼疫苗試驗的研究設計。(圖/作者團隊提供)
3. 德國的「AZ-BNT」疫苗混打的研究
德國柏林的研究團隊以第四期上市後監測評估AZ-BNT混打相較於BNT-BNT疫苗施打之效益與副作用,該研究共納入340位60歲以下的醫護人員,其中189位受試者完整施打兩劑BNT疫苗,兩劑間隔3週;而有110位受試者先注射AZ疫苗再注射BNT疫苗,兩劑間隔10-12週。
圖三為德國AZ-BNT疫苗混打研究設計。該研究發現不論是血清中和抗體反應和T細胞免疫反應,「AZ-BNT」疫苗混打組都優於兩劑皆施打BNT疫苗組,安全性方面,「AZ-BNT」疫苗混打組發生全身性不良反應如發燒、發冷、頭痛、肌痛和疲勞等的比例為51.5%,較兩劑皆施打BNT疫苗組(64.8%)來得低;此外,「AZ-BNT」疫苗混打組發生局部不良反應的比例為84.9%,雖然較兩劑皆施打BNT疫苗組(74.2%)稍高,但大多是輕中度並可自行緩解(Hillus et al., 2021)。
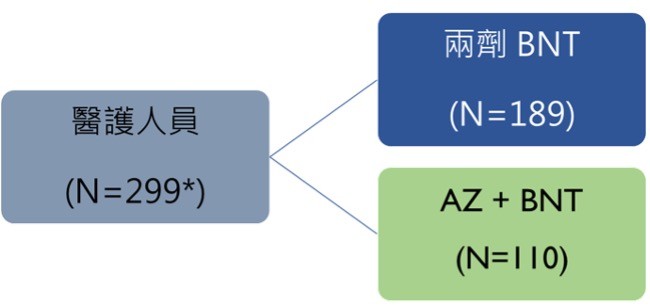
▲圖三:德國疫苗混打研究設計。(圖/作者團隊提供)
*26位個案先前已感染,8位退出研究改接種AZ-AZ,7位個案未完成檢測
瑞典的「AZ-Moderna」疫苗混打的研究
此研究納入曾施打一劑AZ疫苗的醫護人員,其中31位受試者第二劑選擇繼續施打AZ疫苗,51位受試者第二劑選擇施打Moderna疫苗(圖四),研究發現「AZ-Moderna」疫苗混打組的血清中和抗體保護力較兩劑皆施打AZ疫苗組來得高。
在安全性方面,不論是局部或全身性的不良反應,「AZ-Moderna」疫苗混打組發生的比例都比兩劑皆施打AZ疫苗組高,最常見的局部不良反應為注射部位疼痛,發生比例高達80%,對照兩劑皆施打AZ疫苗組,只有近60%的受試者會發生;而常見的全身性不良反應包括疲倦、頭痛、發燒、發冷、肌痛和關節痛,「AZ-Moderna」混打組發生這些全身性不良反應的比例為10%到40%,對照兩劑皆施打AZ疫苗組,發生比例則為5%到25%,但若將不良反應的嚴重度列入考量,「AZ-Moderna」疫苗混打組發生輕度和中度不良反應的比例分別為80%和30%,兩劑皆施打AZ疫苗組則分別為90%和10%,統計學上不具有顯著差異,且由此可知「AZ-Moderna」混打組的不良反應大多都是輕中度(Normark et al., 2021)。
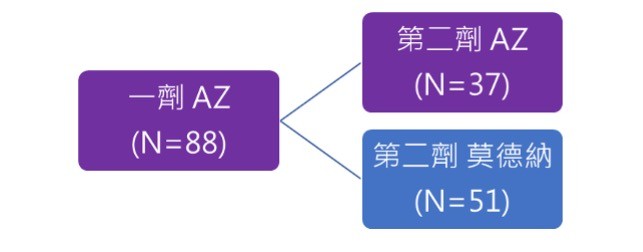
▲圖四:瑞典 AZ-Moderna 混打研究設計。(圖/作者團隊提供)
疫苗混打對抗變種病毒效力的科學證據
1.「AZ-Moderna」疫苗混打對抗變種病毒的瑞典研究
前述在瑞典進行的「AZ-Moderna」疫苗混打的研究同時也提供對於變種病毒株的效果評估結果,此研究針對16位「AZ-Moderna」疫苗混打組受試者與18位兩劑皆施打AZ疫苗組受試者的血清中和抗體進行檢測,發現兩組皆可對瑞典初始流行的病毒株有保護效力,但「AZ-Moderna」疫苗混打組血清中和抗體的保護效力顯著較高,此外,相較於兩劑皆施打AZ疫苗組無法有效產生對抗南非株(B.1.351,Beta)的中和抗體,「AZ-Moderna」疫苗混打組對於南非株 (B.1.351,Beta)仍具保護效力(Normark et al., 2021)。
2.「AZ-BNT」疫苗混打對抗變種病毒的德國研究
另一個在德國執行的「AZ-BNT」疫苗混打的研究為第四期上市後監測的結果,共納入共133位小於60歲的醫護人員,受試者可以自由選擇「先AZ後AZ」(32位受試者)、「先AZ後BNT」(55位受試者)和「先BNT後BNT」(46位受試者)三種疫苗施打組合,研究發現「AZ-BNT」疫苗混打組的受試者血清中和抗體對武漢株的保護力和兩劑皆施打BNT疫苗組相當,但「AZ-BNT」疫苗混打組對其他變種病毒株如英國株(B.1.1.7,Alpha)、南非株(B.1.351,Beta)和巴西株 (P.1,Gamma)的保護力優於兩劑皆施打BNT疫苗組;相對於兩劑皆施打AZ疫苗組,「AZ-BNT」疫苗混打組的受試者血清中和抗體對上述四種新冠病毒株的保護力都較高(Barros-Martins et al., 2021)。
綜合言之,疫苗混打不論是「AZ-BNT」或「AZ-Moderna」的組合,在分析受試者的血清中和抗體都有相當不錯的增強保護效力,所產生的高效中和抗體也可有效對抗變種病毒株。
在安全性方面,雖然在英國的研究中發生不良反應的比例較高,但大多為輕中度且可自行緩解,具有良好的耐受性。上述關於各疫苗混打研究之結果整理於表一。
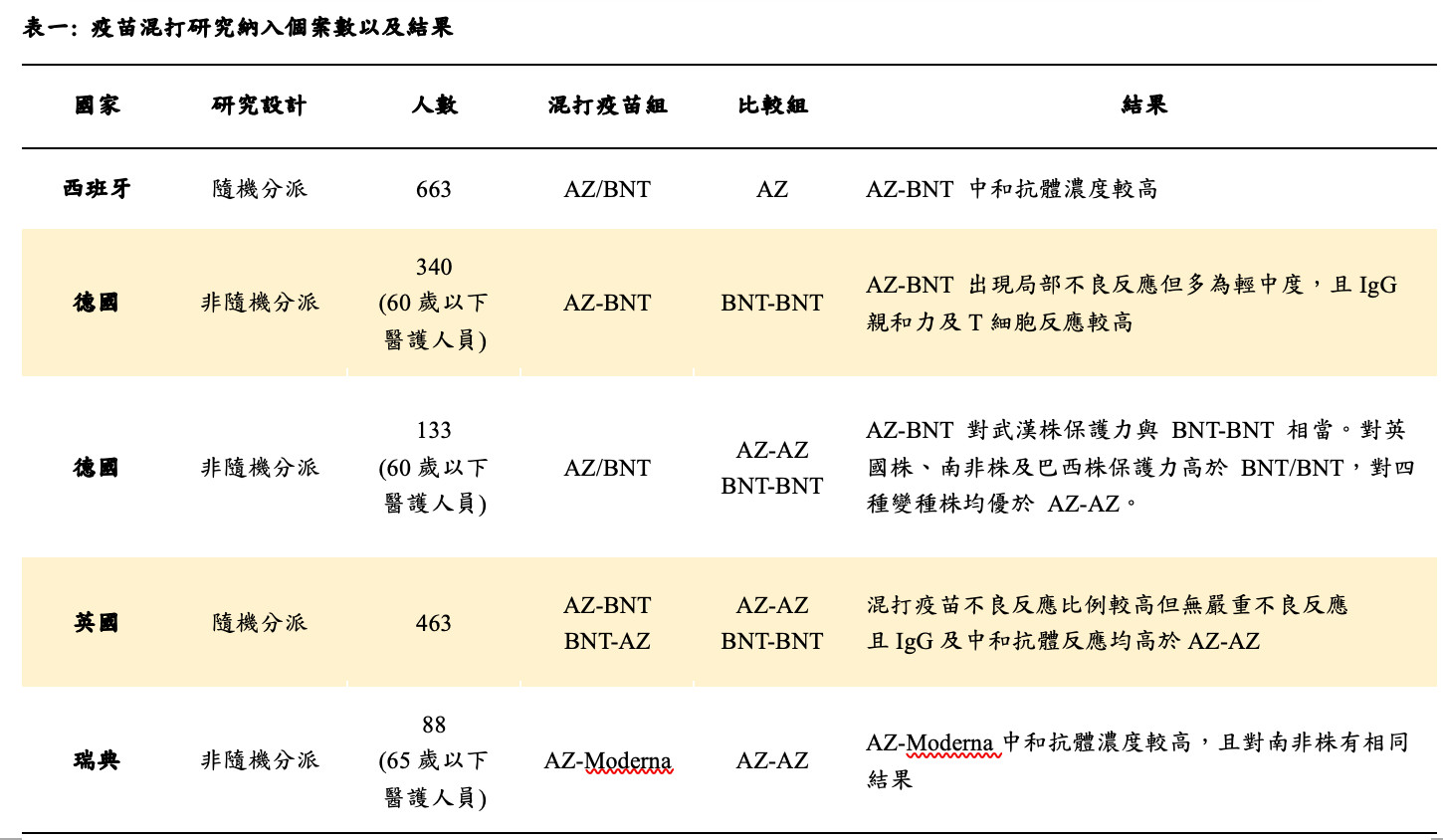
目前疫苗混打研究納入的總個案數介於80到800位之間,研究的主要目的包含對於混合施打的安全性(以發燒之全身性反應或注射部位疼痛紅腫等局部反應做為評估結果)以及免疫原性(Immunogenicity,以中和抗體效價作為主要評估結果),雷同於疫苗發展時第二期臨床試驗之階段(Knipe, 2021)。納入之樣本數約需數百人即足夠。
表二為英國與瑞典疫苗混打研究對於副作用與中和抗體濃度評估之統計檢定力。以英國對於AZ-BNT混打研究為例,該研究共納入463位個案進行評估。針對兩劑AZ比上第一劑AZ加上第二劑BNT,對於發燒之全身性不良反應,其檢定力則約為97%,顯示其所納入之樣本數已足夠做為安全性之推論。
而瑞典的AZ-Moderna混打研究共納入88位個案,對於發燒不良反應評估的檢定力約為36%。若可增加研究個案到440位受試者其統計檢定力即可達到90%。對於中和抗體反應效價增加的評估,前述兩研究對於混打效價高於AZ-AZ效價的統計檢定力皆超過99%。
此結果顯示以研究規模而言,目前的混打臨床試驗結果已可提供對於安全性以及免疫原性之科學實證,後續則需對於混打可達到對於新冠變種病毒之感染、住院、重症,以及死亡之臨床保護力進行科學實證研究,並利用上市後監測機制觀察混打是否會造成其他罕見副作用。

疫苗混打的迫切需求
面臨新冠肺炎之呼吸道新興傳染病世界大流行,除了透戴口罩、勤洗手、保持社交距離、避免人群聚集與隔離檢疫等非藥物公共衛生措施阻斷傳播之外,另一途徑則是研發抗病毒藥物給予患者有效的治療,加速其康復並有效降低傳染力外,而最有效的方式則是快速且廣泛地給予民眾施打疫苗,以達成群體免疫進而控制疫情。
以疫苗控制疫情最成功的例子,便是以色列執行全國性大規模的輝瑞疫苗施打。全國接種率至少達到55%且50歲以上的中老年人接種率則超過9成,而後疫情漸趨緩解並在今年6月解封。
然而,除了少數歐美的高收入國家握有足夠的疫苗之外,大部份國家始終面臨疫苗不足以及延遲到貨的窘境,背後的原因包括美國援引「國防生產法」(Defense Production Act)限制或禁止了疫苗生產所需原材料的出口,而用於疫苗製造的眾多成份中,高達70%來自美國。
此外,印度和中國是國際醫藥市場上的兩個主要生產國和藥品出口國,而這兩個國家接連因為新冠肺炎病毒的肆略,導致製藥工業的停擺,疫苗供應鏈也隨之受到影響。
不論是疫苗不足或延遲到貨,都使得疫苗在分配與國家推行施打計畫上面臨嚴峻的考驗。不同疫苗的分配、供給,以及施打狀況皆可能會造成民眾在施打第一劑疫苗之後,無法在預期的時間內銜接施打同種類的第二劑疫苗。
因此,在疫苗施打的議題上,就出現多元意見,包括第一劑和第二劑的施打間隔,以及當第二劑無法銜接相同的疫苗時,是否可以施打現有的不同種類疫苗等。
此外,因為全球疫情始終無法獲得完全的控制,世界各地一波接著一波的大流行,也讓新冠肺炎演化出許多變種病毒株,其中以英國株(B.1.1.7,Alpha)、南非株(B.1.351,Beta)、巴西株(P.1,Gamma)和印度株(B.1.617,Delta)為引起世界新冠肺炎流行再起的高關注變種病毒(SARS-CoV-2 Variants of Concern, VOCs),已陸續有研究發現單一種類疫苗的使用對於變種病毒的保護效力都有下降的情形,像是AZ疫苗對於英國株(B.1.1.7,Alpha)的保護效力為75%(Emary et al., 2021),但對於南非株(B.1.351,Beta)的保護效力僅有10%(Madhi et al., 2021);而BNT疫苗對於英國株(B.1.1.7,Alpha)的保護效力雖有90%,但對於南非株(B.1.351,Beta)的保護效力就掉到75%(Abu-Raddad et al., 2021);所以藉由不同種類疫苗的混打或許是提升對抗變種病效力的其中一種可能解決之道。
疫苗混打對免疫保護反應之強化效果
新冠肺炎疫苗發展的主要目的在於利用對人體不具傷害性的病毒成分激發人體的免疫反應,使接受疫苗接種的個體在遭遇病毒時由於已產生對病毒的免疫能力而避免受到感染,或免於發生如住院或重症與死亡等嚴重後果。
因此所開發的疫苗除了安全性外,是否能達到足夠以及持續的保護力是重要的科學問題。根源於此一重要的議題,疫苗開發的第二期臨床試驗皆以免疫原性作為主要的評估結果,以確保疫苗可以安全地在人體達到能夠激發免疫反應之目的(Dai and Gao, 2021; Knipe, 2021)。
新冠病毒藉由附著於病毒表面的棘蛋白抗原(Spike protein, S1)的結合位置(Receptor-binding Domain,RBD)與人體呼吸道細胞的ACE2接受器(receptor)合,侵入細胞導致一連串的致病過程以及全身性發炎反應,因此施打疫苗後人體若可產生有效的中和抗體(Neutralizing antibody),即可阻止病毒進入人體,達到避免感染、住院、重症,以及死亡之臨床效益。
前述運用於以色列大規模施打的輝瑞BNT疫苗以及近期世界各國廣泛運用的莫德納mRNA1273與牛津AZD1222疫苗在臨床試驗中皆可以在施打者產生有效的中和抗體達到對於臨床保護效益。
新冠變種病毒如四大變異株Alpha、Beta、Gamma,以及Delta在RBD結合位置的變異不僅對人體細胞的ACE2接受器親和力提高而造成傳播力增加,也削弱了疫苗對於被施打者所訓練出的中和抗體與變種病毒結合的能力,造成疫苗保護力下降的可能(Altmann et al., 2021)。
對變種病毒的研究發現,對於感染非變種病毒的罹病康復者若施打疫苗,不僅其體內中和抗體濃度增加,對於變種病毒的中和能力也高於僅施打疫苗者。圖五呈現自然感染以及疫苗引發人體免疫系統對於新冠病毒保護之效果。
新冠肺炎感染以及疫苗施打共同所引起的抗體免疫(或稱體液性免疫反應,humoral immunity,以B淋巴球為主)、細胞性免疫反應(cellular immunity,以T淋巴球為主),以其兩者的交互協同作用強化人體免疫系統對於新冠病毒的識別能力以及抗性(Crotty, 2021)。
結合近期對於混合疫苗施打造成的高中和抗體保護力的發現,以及前述對於免疫反應的了解,不僅有助於發展對於變種病毒的被動免疫策略以達成族群免疫目標,也為控制高傳播力變種病毒造成的疫情帶來曙光。
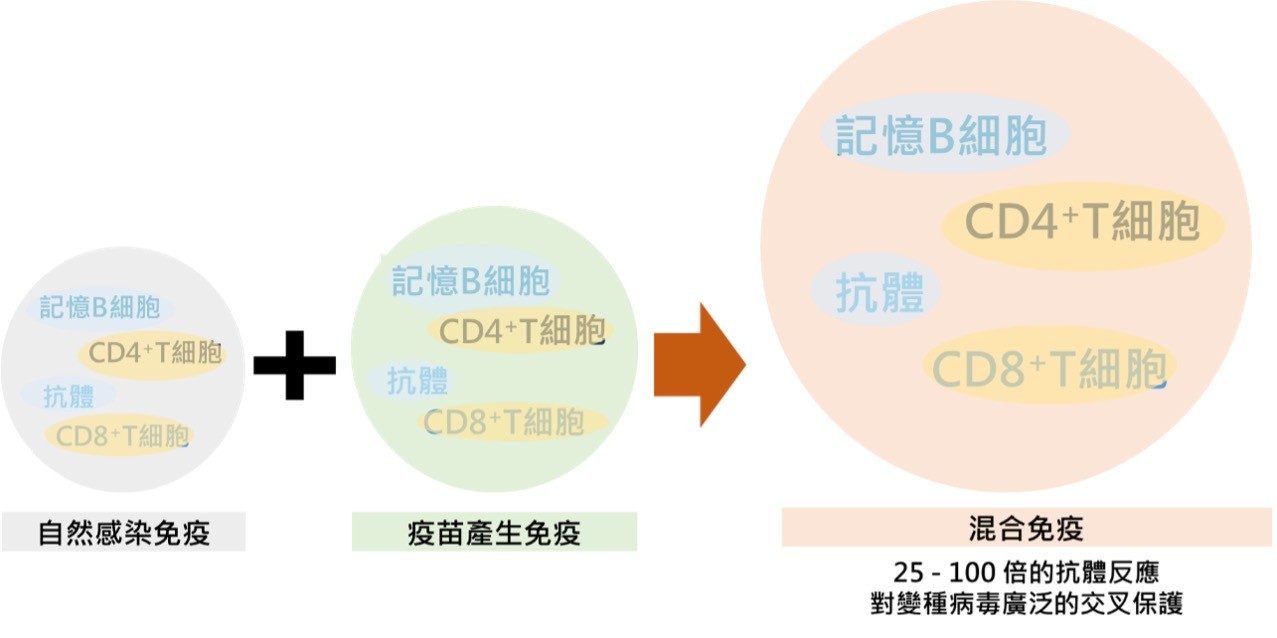
▲圖五:自然感染、疫苗施打,以及混合感染與疫苗造成之免疫保護效果。(圖/作者團隊提供)
以免疫橋接預測混打疫苗臨床保護力
藉由上述疫苗混打的數個研究中,利用這些研究在疫苗混打後所引發的中和抗體濃度比較,可做為疫苗臨床保護力預測。
因此,我們利用AZ及Moderna疫苗的第三期臨床試驗作為施行二劑後中和抗體濃度分布和臨床保護力(主要症狀減低)之免疫橋接關係來推論混打疫苗中和抗體濃度之臨床保護力預測。
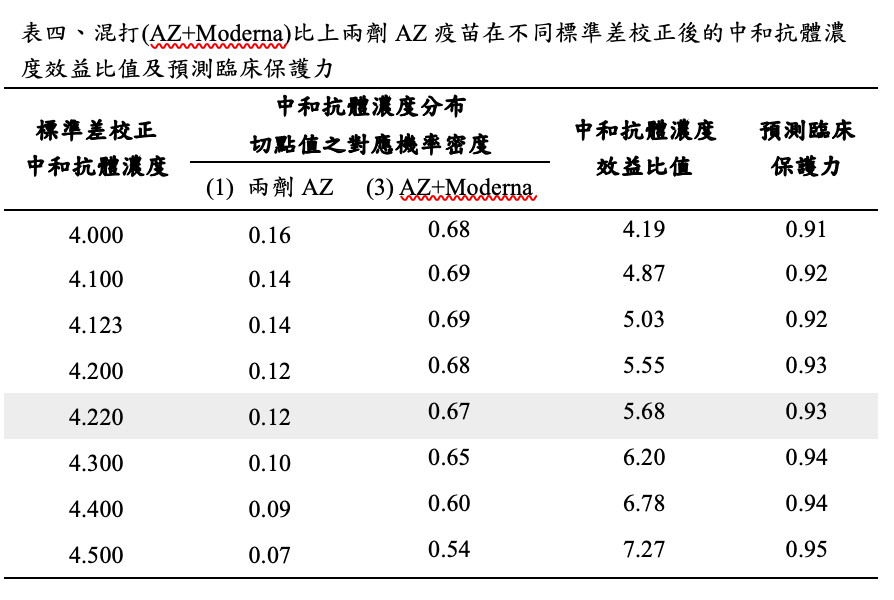
首先利用目前兩劑Moderna(Baden, 2021)及兩劑AZ(Voysey, 2021)在第三期臨床試驗對保護症狀個案發生的臨床效益比(=94%/70.5%),找出相對經過標準差校正後的中和抗體切點值,如表三及圖六所示。
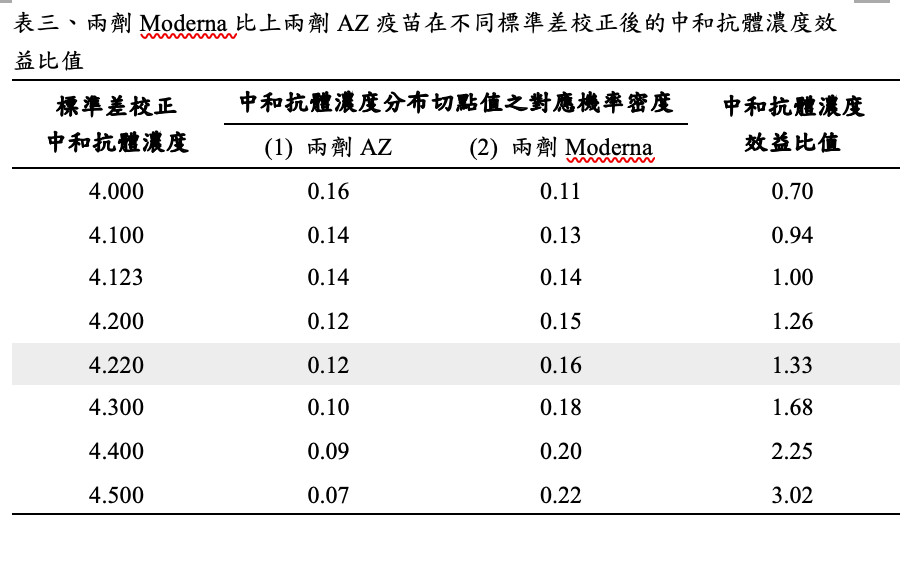
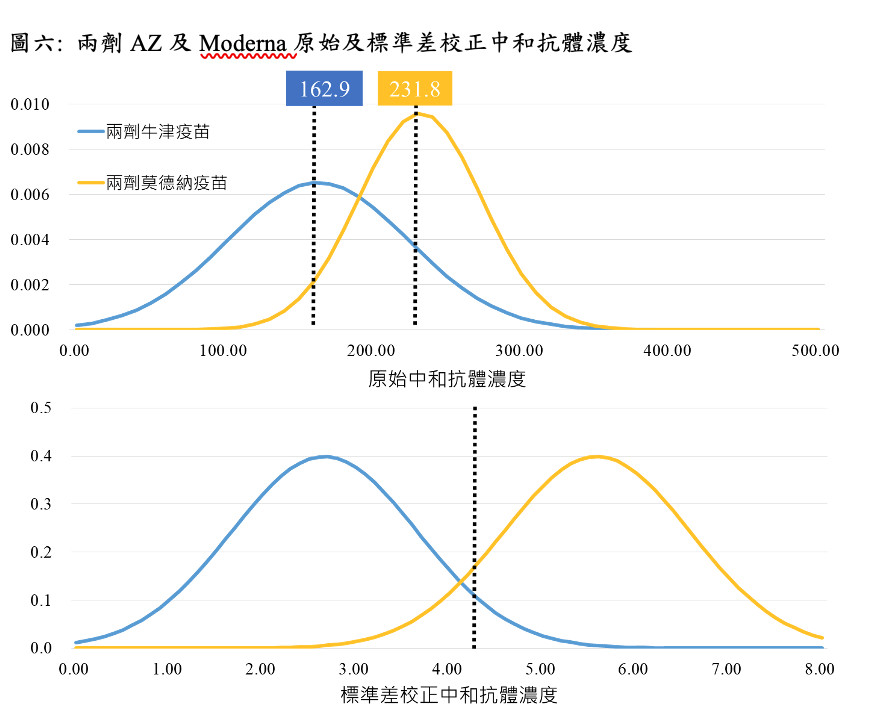
圖六顯示第二期臨床試驗施打兩劑Moderna疫苗28天後的中和濃度表現平均值為231.8(標準差為41.53)(Jackson, 2020),而兩劑AZ疫苗的中和濃度表現平均值為162.9(標準差為61.2)(Folegatti, 2020),依此可計算在Moderna比上AZ疫苗的疫苗效益比約為1.33的情境下,中和抗體濃度經標準差校正後之切點值為4.22,利用此切點值代入混打疫苗之中和抗體濃度分布,進行免疫橋接預測臨床保護力。
若利用上述瑞典的研究施打一個月後的中和濃度平均值為1000,標準差為248.7(Normark, 2021)與標準差校正中和抗體濃度所得之效益比(表四),再與AZ疫苗相比,在4.22的切點值下,可提升效益比至5.68,以此得到預測臨床保護力為93.1%,較原施打兩劑AZ疫苗的70.5%為高,接近於施打兩劑Moderna疫苗的94%臨床效益。
台灣與跨國疫苗混打第三期臨床試驗
對於疫苗混打的臨床效益,雖然可以用中和抗體濃度免疫橋接第三期臨床試驗保護力推估,但若能利用嚴謹科學第三期臨床試驗來證明疫苗混打的真實保護效益,特別是在對抗變種病毒上,則更能夠支持混打效益。
因此在台灣多數民眾已施打第一劑AZ疫苗的時機,可以進行疫苗混打第三期臨床試驗,以台灣做為出發點進行跨國出入境抗變種病毒實證研究。圖七為此台灣與跨國疫苗混打第三期臨床試驗研究設計。
試驗開始的時機是疫苗第二劑供貨充足及國外疫情仍高但卻開始出入境解封可以招募已施打第一劑AZ疫苗而預計會出國且在三個月內返國的觀光旅客,在出國前接受此試驗,受試者經隨機分派為兩組,在出境前一組施打第二劑AZ疫苗,另一組則施打Moderna疫苗,而觀光旅行回國後追蹤兩組比較新冠肺炎確診數、住院及重症個案數是否不同。
在境外現行新冠肺炎發生率為千分之2.5且兩組臨床效益在上述一節已知情形下(AZ為70.5%,AZ+Moderna為93.1%),若統計檢定力欲達80%,估算每組樣本數約需23,000人。這樣的疫苗混打第三期臨床試驗,台灣可以做為國際領頭羊並逐步擴大與其他國家進行跨國臨床試驗,不僅提高台灣在國際疫苗研究上的高度,試驗結果可以提供全世界更有力在疫苗混打特別是在變種病毒防範上的科學實證依據,並做為驗證上述混打疫苗免疫橋接預測臨床保護力之科學突破。
總結
本文針對目前新冠肺炎混打疫苗之需求,利用施打二劑後的第三期臨床試驗結果建立混打疫苗免疫橋接臨床保護力推估模式,預測AZ+Moderna臨床保護力高達93.1%,可支持疫苗混打政策。
最後並提出台灣與跨國疫苗混打臨床試驗以驗証此推估模式,期能提供疫苗混打科學實證依據,以控制變種病毒造成世界大流行。
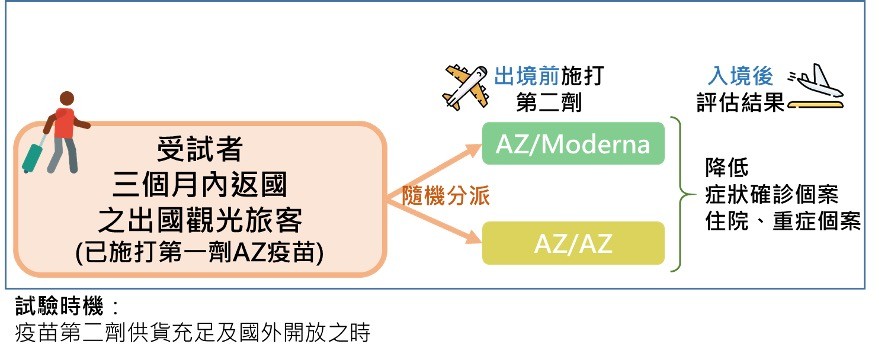
▲圖七:台灣與跨國疫苗混打臨床試驗研究設計。(圖/作者團隊提供)
參考文獻
Abu-Raddad et al. “Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants”N Engl J Med. 2021 Jul 8;385(2):187-189.
Altmann, Daniel M., Rosemary J. Boyton, and Rupert Beale. "Immunity to SARS-CoV-2 variants of concern." Science 371.6534 (2021): 1103-1104.
Baden LR, El Sahly HM, Essink B, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med 2021;384: 403-416.
Barros-Martins et al. “Immune responses against SARS-CoV-2 variants after heterologous and homologous ChAdOx1 nCoV-19/BNT162b2 vaccination”Nat Med. 2021 Jul 14. doi: 10.1038/s41591-021-01449-9. Online ahead of print.
Borobia et al. “Immunogenicity and reactogenicity of BNT162b2 booster in
ChAdOx1-S-primed participants (CombiVacS): a multicentre, open-label, randomised, controlled, phase 2 trial” Lancet. 2021 Jul 10;398(10295):121-130.
Crotty, Shane. "Hybrid immunity." Science 372.6549 (2021): 1392-1393.
Dai, Lianpan, and George F. Gao. "Viral targets for vaccines against COVID-19." Nature Reviews Immunology 21.2 (2021): 73-82.
Emart et al. “Efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine against SARS-CoV-2 variant of concern 202012/01 (B.1.1.7): an exploratory analysis of a randomised controlled trial” Lancet. 2021 Apr 10; 397(10282): 1351–1362.
Folegatti, P. M., Ewer, K. J., Aley, P. K., Angus, B., Becker, S., Belij-Rammerstorfer, S., ... & Hamlyn, J. (2020). Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet, 396(10249), 467-478.
Hillus et al. “Safety, reactogenicity, and immunogenicity of homologous and heterologous prime-boost immunisation with ChAdOx1-nCoV19 and BNT162b2: a prospective cohort study”medRxiv Preprint, doi: https://doi.org/10.1101/2021.05.19.21257334
Jackson, L. A., Anderson, E. J., Rouphael, N. G., Roberts, P. C., Makhene, M., Coler, R. N., ... & Beigel, J. H. (2020). An mRNA vaccine against SARS-CoV-2—preliminary report. New England Journal of Medicine.
Knipe, David M., et al. "Ensuring vaccine safety." Science 370.6522 (2020): 1274-1275.
Liu et al. “Safety and Immunogenicity Report from the Com-COV Study–a Single-Blind Randomised Non-Inferiority Trial Comparing Heterologous And Homologous Prime-Boost Schedules with An Adenoviral Vectored and mRNA COVID-19 Vaccine” Lancet Preprint, Available at SSRN: http://dx.doi.org/10.2139/ssrn.3874014
Normark et al. “Heterologous ChAdOx1 nCoV-19 and mRNA-1273 Vaccination” N Engl J Med. 2021 Jul 14. doi: 10.1056/NEJMc2110716. Online ahead of print.
Madhi et al. “Efficacy of the ChAdOx1 nCoV-19 Covid-19 Vaccine against the B.1.351 Variant” N Engl J Med. 2021 May 20;384(20):1885-1898.
Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2021;397: 99-111.







我們想讓你知道…綜合言之,疫苗混打不論是「AZ-BNT」或「AZ-Moderna」的組合,在分析受試者的血清中和抗體都有相當不錯的增強保護效力,所產生的高效中和抗體也可有效對抗變種病毒株。