▲莫德納、嬌生、輝瑞疫苗。(圖/路透)
● 許辰陽/台灣大學公共衛生學院公共衛生碩士學位學程兼任助理教授
● 嚴明芳/台北醫學大學口腔衛生學系教授
● 賴昭智/台北市立聯合醫院仁愛院區主治醫師
● 林庭瑀/台灣大學公共衛生學院預防醫學與流行病學研究所博士後研究員
● 陳秀熙/台灣大學公共衛生學院預防醫學與流行病學研究所教授
高疫苗覆蓋下的新冠肺炎疫情再起
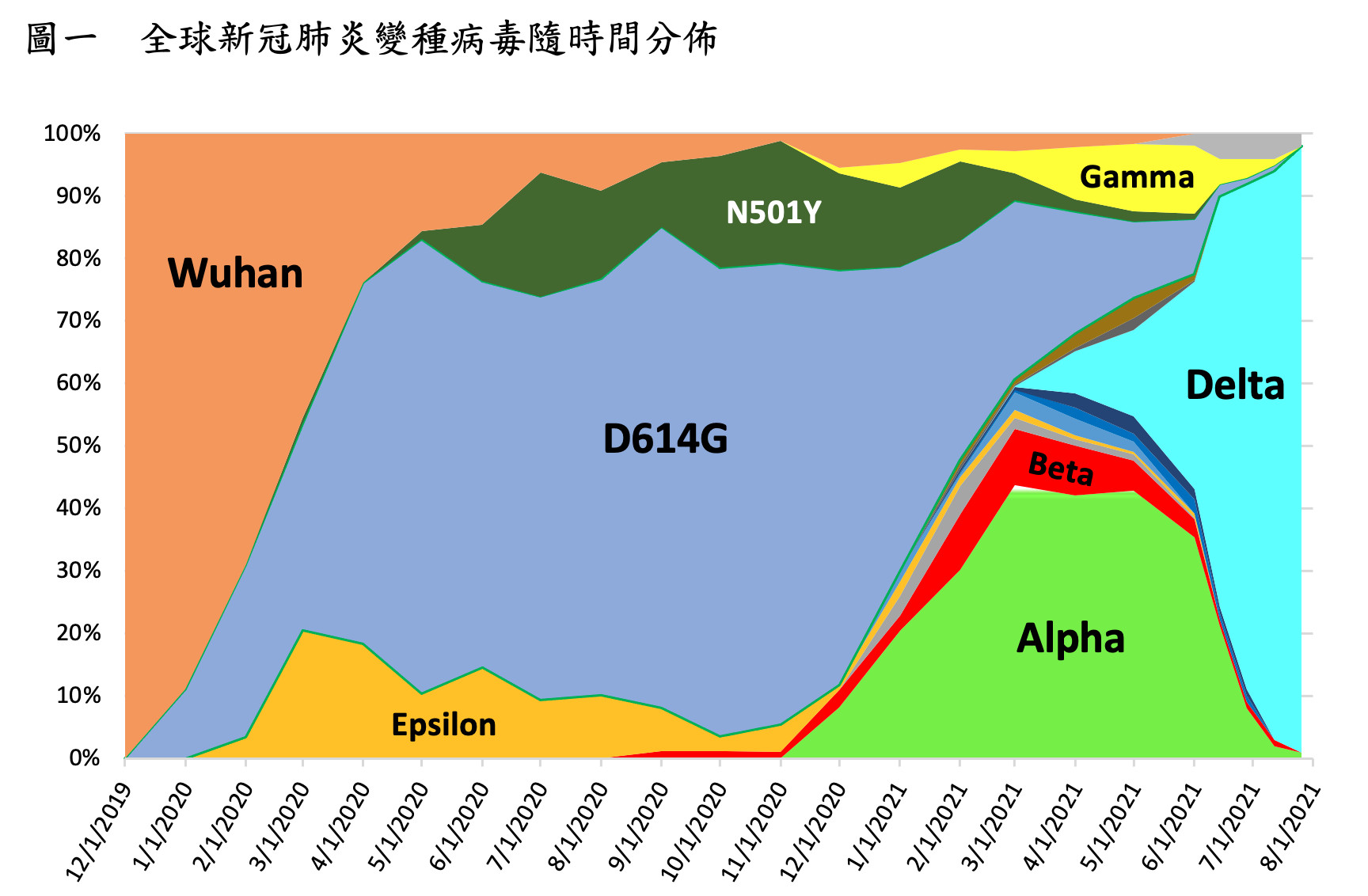
從去(2020)年12月份英國第一個開始全國新冠肺炎疫苗施打計畫以來,許多高疫苗施打率的國家隨著疫苗接種覆蓋率的增加,每日新增的新冠肺炎確診個案數有了顯著的控制,但這樣的情境在面對新冠肺炎變種病毒的不斷演化有了新的改變,從圖一可以看到在2021年初Alpha變種病毒株逐漸主導全球新冠肺炎病毒的分佈,而到4月開始Delta病毒株的比例慢慢增加,直至7月份已經變成了全球的主要病毒株。
對應到各國的流行曲線,許多疫苗高施打的國家本來在6月份左右疫情已經幾乎完全控制,而且也逐步提出解封計畫,卻在6、7月份開始有了新一波的流行再起。
以全世界人口數超過500萬國家中疫苗施打率最高的20個國家為例,在8月初竟然有一半的國家單日新冠肺炎發生率佔全人口的十萬分之15,除了阿拉伯聯合大公國之外,其他國家3月到6月之間其實已經控制的非常好,其疫情流行曲線卻又在近期有疫情升溫的狀況(見圖二)。
這樣的高疫苗疫苗接種覆蓋率,已施打疫苗的民眾卻仍舊受到變種病毒感染,歸咎原因除了未施打者因公衛防疫措施鬆懈所造成群聚感染之外,疫苗突破性感染(Vaccine Breakthrough)可能是另一重要因素。
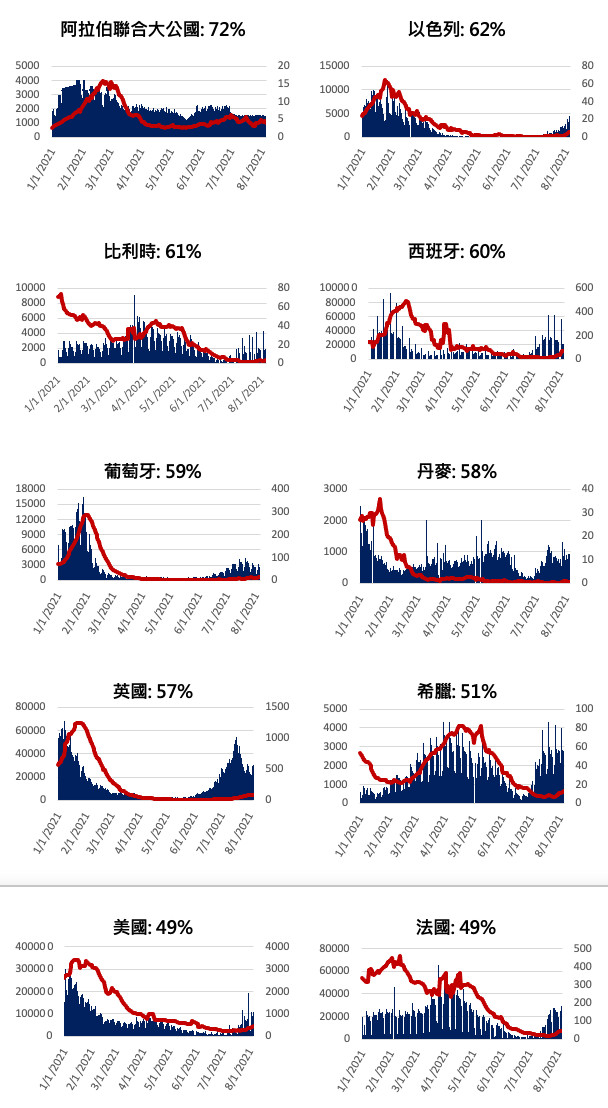
▲圖二、全球十大完整疫苗接種率高且發生率高之國家新冠肺炎每日確診與死亡人數。(圖/作者團隊提供)
(圖表上方顯示國家及對應的完整疫苗接種率,圖表內藍色區塊Y軸(左側)為單日個案數,紅色曲線Y軸(右側)為單日死亡數。左側Y軸為個案數,右側Y軸為死亡數)
疫苗突破性感染(Vaccine Breakthrough)定義及生物機轉
目前對於疫苗突破性感染的定義為接受完整疫苗施打14天後所發生的新冠肺炎感染。
雖然過往針對武漢演化株所發展的疫苗如牛津疫苗(AZD1222)、莫德納疫苗(mRNA1273)、輝瑞疫苗(BNT162b2)等在臨床試驗以及上市後監測評估顯示接種者對於受到新冠病毒(SARS-CoV-2)感染或發生新冠肺炎疾病(COVID-12)以及重症等皆具有高度的保護力。但近期由於Delta變異株造成世界流行再起則陸續有完整接受疫苗施打的個案卻又發生感染報導。
新冠病毒入侵宿主細胞達到感染傳播須先接合至宿主細胞並且與宿主細胞膜融合,將病毒RNA注入細胞中。此過程中病毒會利用人體呼吸道細胞膜表面富含之血管收縮素轉化酶(angiontensin-converting enzyme 2,ACE2)以及跨膜絲氨酸蛋白酶(Transmembrane Serine Protease 2,TMPRSS2)達到入侵人體細胞之目的。
其中ACE2主要與病毒與人體細胞接合有關,而TMPRSS2則與病毒接合運用宿主細胞之蛋白酶Furin使病毒顆粒脫離棘蛋白並且與人體細胞膜融合使病毒RNA進入人體細胞進行後續的複製有關。
新冠病毒(SARS-CoV-2)主要藉由附著於病毒表面之棘蛋白(Spike protein)與ACE2結合入侵宿主細胞達到病毒傳播之目的,因此棘蛋白與ACE2結合之強度與新冠病毒之傳播力大小息息相關。
新冠病毒表面約有24-40個棘蛋白,每個棘蛋白由1273個胺基酸構成,包含兩個部分:與ACE2結合強度相關的S1(第14到685胺基酸)以及與病毒-宿主細胞膜融合並釋放病毒RNA至宿主細胞內之S2(第686到1273胺基酸)部分(Huang et al., 2020)。
其中主要與宿主細胞ACE2結合的位置(Receptor-binding domain,RBD,位於第319到541胺基酸)即位於S1部分(圖三)。
因此若變種病毒在RBD或鄰近之胺基酸位置發生變異影響改變棘蛋白之結構,對於病毒的傳播力就會產生影響。
造成2020年世界大流行的武漢演化株即是由於RBD下方之胺基酸發生變異,在第614個胺基酸位置由甘胺酸(Glycine,簡寫為G)取代了原本的天冬氨酸(Aspartic acid,簡寫為D),發生D614變異使結合位置較為突出而強化該變異株的傳播力(Koenig and Schmidt, 2021; Zang et al., 2021)。
而造成2021年初期世界流行波的Alpha變種病毒(B.1.1.7,英國株),則是在病毒RBD胺基酸發生變異(第501個胺基酸,由天門冬醯酸(Asparagine,N)突變酪胺酸(Tyrosine,Y)造成N501Y變異)使其結構改變,因此其結合部位之穩定度增加,傳播力也隨之加強並成為2021年初期之優勢病毒株造成世界大規模流行(Scudellari, 2021)。
除了影響傳播力此之外,變異病毒也可能減弱由施打疫苗或先前感染所產生的中和抗體結合能力,降低抗體之保護力,此稱為變種病毒免疫識別逃脫(Immune escape)的機轉之一。
由於施打疫苗的主要目在於刺激人體免疫系統產生對於病毒入侵的抵抗力,目前新冠疫苗發展的主要技術如mRNA疫苗、載體疫苗,重組蛋白疫苗等主要目標皆是使人體暴露於修飾後的部分棘蛋白,以刺激人體產生可結合於RBD的中和抗體,達到避免病毒入侵以及感染或發展成為重症之目的。
源於此疫苗保護機轉,各臨床研究皆運用對於D614G或其他變種病毒的中和抗體濃度作為疫苗發展時重要的保護力評估指標。
然而由於變種病毒於前RBD發生變異造成結構改變,也使疫苗保護力下降而產生疫苗突破性感染的發生。在棘蛋白發生的突變中,以第484到489位置的氨基酸突變影響最為顯著(Harvey et al., 2021)。
例如E484K由麩胺酸(Glutamic acid,E)突變成為離胺酸(Lysin,K),發生於四大變種病毒中的Beta以及Gamma變異株中(CDC, 2021a),疫苗對此兩株變異病毒得中和抗體保護力也因此大幅下降(Harvey et al., 2021; Forman et al., 2021; Choi et al., 2021)。
而自2021年中開始成為世界優勢病毒株的Delta 變異株,其L452R胺基酸變異由於位在RBD處,產生免疫識別逃脫並造成中和抗體保護力下降(Harvey et al., 2021)。
Delta 變異株帶有的T478K亦為構成RBD胺基酸第478個位置由息寧胺酸(Threonine,T)突變為離胺酸(Lysine,K),由於此變異也位在抗體結合位置,可能與E484K共同強化Delta變異株的免疫辨識逃脫之特性 (Planas et al., 2021)。
近期引起國際關注的Delta Plus則為Delta 變異株加上K417N,第417位置胺基酸由離胺酸(Lysine,K)突變為天門冬醯酸(Asparagine,N)也進一步造成此變異株之免疫辨識逃脫(CDC, 2021a; Harvey et al., 2021)。
除此之外,該變異株的P681R變異位於S1與S2交界處,使病毒在結合到宿主細胞膜表面ACE2受體後更容易運用人體之TMPRSS2以及Furin蛋白酶提高病毒顆粒與人體細胞融合之效率,使病毒RNA更容易進入人體細胞進行複製,而造成感染者具有高病毒量之結果(Harvey et al., 2021)。
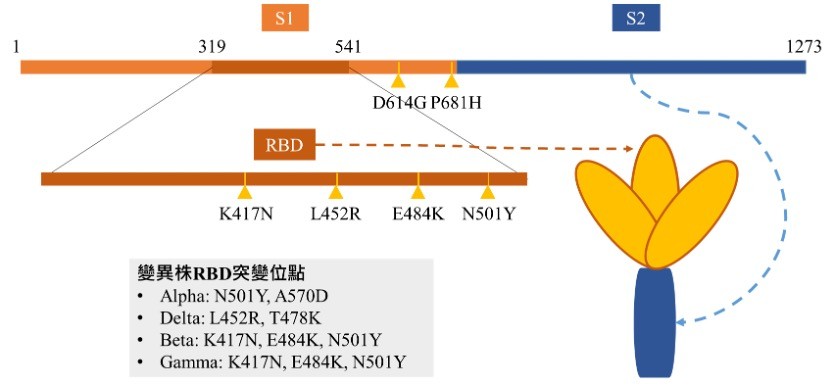
▲圖三、新冠病毒表面棘蛋白、胺基酸結構及變異株突變位點。(圖/作者團隊提供)
隨著新冠肺炎疫情擴大,病毒在人群中持續傳播與複製可預期新冠病毒變異將不斷發生,若產生免疫識別逃脫的氨基酸變異加上可提高ACE2結合力的變異同時發生,則預期中和抗體保護力將降低而世界疫苗有突破性感染之亦情發生。
疫苗突破性感染的科學實證
Delta變種病毒對於疫苗突破性感染是否對於疫情造成威脅,已有相關科學實證研究。首先在Alpha變種病毒盛行期間(2021年1-4月),以色列針對1497名完整接種兩劑BNT疫苗的醫護人員中,就發現有39人產生疫苗突破性感染(2.6%),但多為無症狀或輕微症狀,進一步利用病例對照設計相較於完整接種疫苗而未受感染者,發現這些疫苗突破性感染者其中和抗體濃度都較未受感染者低(約0.36倍),並且中和抗體濃度越低其被感染時病毒量會越高,表示突破性感染可能與接種疫苗後產生之中和抗體濃度有關(Bergwerk, et al. NEJM, 2021)。
相對於Alpha變種病毒的突破性感染,Delta變種病毒的突破性感染比例就更為顯著,印度在2021年1至5月受到Delta病毒侵襲的期間,抽樣基因定序顯示該期間Delta病毒佔69.5%,發現仍有8.6%的醫護人員在接受完整施打兩劑AZ疫苗後仍感染到新冠肺炎,不過97%的感染者亦為輕症(Pratibha Kale et al., medRxiv, 2021),印度另一項研究亦顯示在Delta病毒盛行的4-5月,施打Covaxin或AZ疫苗之醫護人員突破性感染比例分別為13.7%與8.2%(Pragya Sharma1 et al., medRxiv, 2021)。

▲印度疫苗Covaxin。(圖/達志影像/美聯社)
美國德州-休斯敦針對3,913名病患進行基因定序,其中255位病患為完整接種兩劑mRNA疫苗14天後感染之個案,其中屬Delta病毒感染者其突破性比例為19.7%明顯高於非Delta變種病毒感染者的5.8%(James M. Musser et al., medRxiv, 2021)。
美國近期亦持續遭受Delta變異株影響,確診數持續攀升。美國疾病管制中心(CDC)對於疫苗突破感染的常規監測結果顯示,在目前以施打疫苗的族群中(1億6千4百萬人中,有7525個須住院治療之突破性感染個案),發生率為每十萬人4.6(CDC,2021b)。
東岸的麻薩諸塞州7月出現多起酒吧、餐廳及青年旅館等大型群聚感染,報告中發現469例確診者中有74%(346人)為完整接種BNT疫苗後突破性感染,完成基因定序檢體中有90%為Delta病毒株,完整施打(Ct值22.8)或無施打疫苗(Ct值21.5)之Ct值皆很低,顯示Delta病毒可能增加疫苗施打後突破性感染風險(Brown et al., 2021)。
廣東在2021年5月到6月間亦有Delta 變種病毒爆發群聚之疫情,並造成167位個案,對於該波疫情之調查顯示受到Delta 病毒感染個案具有高病毒量(為2020年中國流行病毒株的1260倍)以及較短之潛伏期特性(縮短2天),顯示Delta變異株之高傳播力(Li et al., 2021)。
中國雖已大規模施打科興疫苗,全國施打兩劑涵蓋率高達65%,但在科興疫苗保護力僅50%之情形下,仍受到Delta疫情爆發之威脅(Khoury et al., 2021;WHO, 2021)。
如何因應疫苗突破性感染
為能因應疫苗突破性感染,在疫苗策略上可能可以採用的方法說明如下:
1.疫苗混打增強對抗變種病毒保護力
不論是「AZ-BNT」或「AZ-Moderna」的疫苗混打研究,在分析受試者的血清中和抗體都有相當不錯的增強保護效力,疫苗混打所產生的高效中和抗體也可有效對抗變種病毒株。
在德國的疫苗混打研究中發現AZ加上BNT混打,對Alpha、Beta及Gamma變種病毒保護力均高於二劑BNT,而瑞典的AZ加莫德納混打研究也顯示對Beta變種病毒仍具保護效力。
2.疫苗第三劑追加施打
針對Delta變種病毒的突破性感染,許多歐美國家也決定施打第三劑因應。美國的輝瑞BNT疫苗刻正對第三劑施打向美國食藥署提出EUA使用的修正,建議施打第二劑後的6-12個月在追加第三劑,以維持抗體及保護力。
而英國、以色列、德國及法國等國已計畫在秋天來臨時對脆弱族群如免疫功能低下、老人等施打第三劑疫苗,以維持他們的抗體保護力。
疫苗的追加施打可對受到抗體標註的B細胞繁殖並提高抗體濃度以對抗病原體,而留在B細胞的記憶也會更大,待下次暴露於病毒時抗體能有更快速與更強的反應。
3.一劑疫苗加上非藥物公衛介入措施
對於低社區感染流行國家如台灣,一劑AZ或mRNA疫苗加上口罩及社交距離的防疫措施,也應能對變種病毒有一定的保護力及防疫效果,由於有一劑的抗體保護既使有突破性感染也不致於重症。
非藥物公衛措施對於此波世界Delta變異株疫情控制效益,也見諸於國際疫情控制策略。
如德國、加拿大,以及匈牙利等國(圖四)除推行疫苗施打政策外,結合高規格入境檢測防杜Delta變異株之境外移入並運用篩檢偵測以及前述多重非藥物公衛介入達到對於疫情控制之目的。
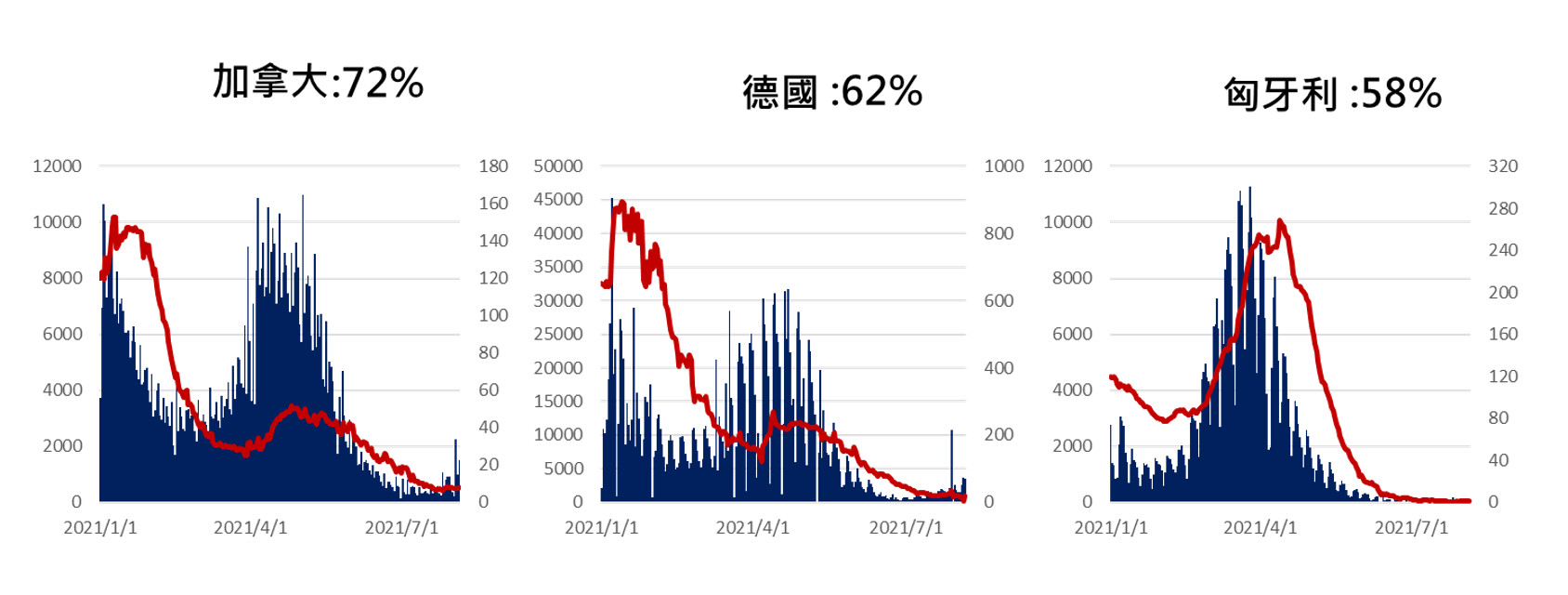
▲圖四、德國、加拿大,以及匈牙利新冠肺炎每日確診與死亡人數。(圖/作者團隊提供)
(圖表上方顯示國家及對應的完整疫苗接種率,圖表內藍色區塊Y軸(左側)為單日個案數,紅色曲線Y軸(右側)為單日死亡數。左側Y軸為個案數,右側Y軸為死亡數)
面對Delta世界疫情再起,台灣也加強入境管理,運用檢測、檢疫,與隔離等措施防止境外移入個案造成社區傳播。
台灣雖在6月也面臨Delta 病毒群聚疫情之威脅,在運用檢測快速找出個案結合隔離、檢疫、接觸者追蹤加上民眾對於口罩與社交距離的落實以及5月即對於醫療工作人員廣泛推行疫苗施打達到高涵蓋率,免於疫情擴散。
該波疫情共有17人受到Delta變異株感染。
4.次世代疫苗之發展
面對新冠病毒層出不窮的變異以及引起的世界疫情,生物科學界也積極發展次世代疫苗。目前主要的策略為發展對於多個變異位置發展多校價之疫苗。
例如以目前國際間廣泛使用的mRNA疫苗,可運用對於前述變異位置設計次世代疫苗所含有之mRNA,激發人體免疫系統產生可有效與變異病毒結合,避免人體受到感染。
不同的疫苗技術如載體與重組蛋白也在同樣的思維下發展能對抗變種病毒之次世代疫苗(Cohen, 2021)。
然而這些方法是否足以對付Delta變種病毒突破性感染,都尚待更多的科學實證研究來佐證。
目前科學家仍持續研發次世代疫苗,包含以變種新冠病毒棘蛋白基因序列修改目前mRNA疫苗,或運用棘蛋白低變異區製作廣泛可對抗各病毒之疫苗、或是運用一系列不同三聚體棘蛋白製作多價棘蛋白疫苗,以及多價RBD疫苗,以能一勞永逸對付持續變異的新冠變種病毒。
Delta病毒除了以高傳播力之特性,並利用其免疫逃脫造成疫苗突破性感染,使得這些高疫苗施打國家在公衛防疫措施鬆懈之下造成第三波世界流行再起。如何解決此疫苗突破性感染是控制目前歐美國家疫情的重要科學議題。
參考文獻
Bergwerk M, Gonen T, Lustig Y, et al. Covid-19 Breakthrough Infections in Vaccinated Health Care Workers [published online ahead of print, 2021 Jul 28]. N Engl J Med.
2021;10.1056/NEJMoa2109072. doi:10.1056/NEJMoa2109072
Brown CM, Vostok J, Johnson H, et al. Outbreak of SARS-CoV-2 Infections, Including COVID-19 Vaccine Breakthrough Infections, Associated with Large Public Gatherings — Barnstable County, Massachusetts, July 2021. MMWR Morb Mortal Wkly Rep 2021;70:1059-1062.
CDC, 2021a. SARS-CoV-2 Variant classification and definitions. Accessed at https://www.cdc.gov/coronavirus/2019-ncov/variants/variant-info.html on 2021-Aug-12.
CDC, 2021b. COVID-19 breakthrough case investigations and reporting. Accessed at https://www.cdc.gov/vaccines/covid-19/health-departments/breakthrough-cases.html on 2021-Aug-12.
Choi, Angela, et al. "Serum neutralizing activity of mRNA-1273 against SARS-CoV-2 variants." bioRxiv (2021).
Cohen, Jon. "The dream vaccine." (2021): 227-231.
Harvey, William T., et al. "SARS-CoV-2 variants, spike mutations and immune escape." Nature Reviews Microbiology 19.7 (2021): 409-424.
Huang, Yuan, et al. "Structural and functional properties of SARS-CoV-2 spike protein: potential antivirus drug development for COVID-19." Acta Pharmacologica Sinica 41.9 (2020): 1141-1149.
Kale P, Gupta E, Bihari C, et al. Clinicogenomic analysis of breakthrough infections by SARS CoV2 variants after ChAdOx1 nCoV- 19 vaccination in healthcare workers. medRxiv. 2021. Preprint doi: https://doi.org/10.1101/2021.06.28.21259546
Khoury, David S., et al. "Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection." Nature medicine (2021): 1-7.
Koenig, Paul-Albert, and Florian I. Schmidt. "Spike D614G—A Candidate Vaccine Antigen Against Covid-19." New England Journal of Medicine 384.24 (2021): 2349-2351.
Li, Baisheng, et al. "Viral infection and transmission in a large well-traced outbreak caused by the Delta SARS-CoV-2 variant." medRxiv (2021).
Musser JM, Christensen PA, Olsen RJ, et al. Delta variants of SARS-CoV-2 cause significantly increased vaccine breakthrough COVID-19 cases in Houston, Texas. medRxiv, 2021. Preprint doi: https://doi.org/10.1101/2021.07.19.21260808
Planas, Delphine, et al. "Reduced sensitivity of SARS-CoV-2 variant Delta to antibody neutralization." Nature (2021): 1-7.
Scudellari, Megan. "How the coronavirus infects cells-and why Delta is so dangerous." Nature 595.7869 (2021): 640-644.
Sharma P, Mishra S, Basu S, et al. Breakthrough infection with SARS-CoV-2 and its predictors among healthcare workers in a medical college and hospital complex in Delhi, India. medRxiv. 2021. Preprint doi: https://doi.org/10.1101/2021.06.07.21258447
Wall, Emma C., et al. "Neutralising antibody activity against SARS-CoV-2 VOCs B. 1.617. 2 and B. 1.351 by BNT162b2 vaccination." The Lancet 397.10292 (2021): 2331-2333.
WHO. Results of COVID-19 vaccination effectiveness studies: An ongoing systematic review. 2021.
熱門點閱》
► 李沃牆/發行成本逾23億「振興五倍券」跟「普發現金」孰優?
● 以上言論不代表本網立場。歡迎投書《雲論》讓優質好文被更多人看見,請寄editor88@ettoday.net,本網保有文字刪修權。







我們想讓你知道…Delta病毒除了以高傳播力之特性,並利用其免疫逃脫造成疫苗突破性感染,使得這些高疫苗施打國家在公衛防疫措施鬆懈之下造成第三波世界流行再起。